1. 원자론
1) 일정 성분비 법칙 law of definite proportions
: 한 화합물을 구성하는 각 성분 원소들의 질량비는 일정하다.
예) 물 분자의 질량비는 수소 11.19%, 산소 88.81%이고 물의 상태가 얼음이나 수증기가 되거나 강물이나 지하수에 있더라도 항상 같은 양의 질량비를 가지고 있다.
2) 배수 비례 법칙 law of multiple proportions
: 2종류 이상의 원소가 화합하여 2종 이상의 화합물을 만들 때, 한 원소의 일정량과 결합하는 다른 원소의 질량비는 항상 간단한 정수비를 나타낸다.
예) 질소와 산소의 5종류의 화학물 N2O, NO, N2O3, NO2, N2O5에서 질소 140g과 결합하는 산소의 질량은 각기 8, 16, 24, 32, 40(g)이며, 그 비는 1:2:3:4:5가 된다.
3) 질량 보존 법칙 law of conservation of mass
: 닫힌 계의 질량이 화학 반응에 의한 상태 변화에 상관없이 변하지 않고 계속 같은 값을 유지한다.
예) 수소 1g과 산소 8g을 이용하여 수증기 9g을 만든다.
2. 원자의 구조
1) 원소(element)와 원자(atom)
원소(element)는 물질을 이루는 기본적인 성분을 나타내는 말로 추상적인 의미이고, 원자(atom)는 물질을 이루는 가장 작은 입자라는 개념으로 셀 수 있고 구체적이다. 이를테면 물 H2O가 있다면 이를 구성하는 원소는 수소와 산소이다. 하지만 이를 구성하는 원자는 ‘수소 원자 2개와 산소 원자 1개다’라고 말한다.
2) 아원자 입자 subatomic particle
원자는 아원자 입자라는 훨씬 더 작은 입자로 이루어져 있다.
| 아원자 입자 subatomic particle | 질량(g) | 전하 | ||
| 전하량(쿨롱) | 전하 단위 | |||
| 전자 electron | 9.10938 × 10-28 | -1.6022 × 10-19 | -1 | |
| 핵 nucleus | 양성자 proton | 1.67262 × 10-24 | +1.6022 × 10-19 | +1 |
| 중성자 neutron | 1.67262 × 10-24 | 0 | 0 | |
3. 원자 번호, 질량수 및 동위원소
▷ 양성자수 = 원자 번호 atomic number, Z
▷ 질량수 mass number, A = 양성자수 + 중성자수 = 원자 번호 + 중성자수
▷ 동위원소 isotope : 원자번호는 같지만 질량수가 다른 원자
4. 주기율표 periodic table
https://ptable.com/#Properties
주기율표 - Ptable
본 다이나믹 주기율표를 통하여 이름, 시청각 데이타, 실시간 검색이 가능합니다. 화학원소를 클릭하시면 전체데이타를 보실 수 있습니다.
ptable.com
열: 주기 period / 행: 족 group
5. 분자와 이온
1) 분자 molecule
: 화학적 힘에 의해 일정한 배열을 유지하는 두 개 이상 원자의 응집체
| 단원자 분자 monatomic molecule |
이원자 분자 diatomic molecule |
다원자 분자 polyatomic molecule |
| 원자 하나가 분자를 이룬다. | 두개의 원자가 분자를 이룬다. | 세개 이상의 원자가 분자를 이룬다. |
2) 이온 ion
: 알짜 양전하나 알짜 음전하를 가진 원자 또는 원자단
| 양이온 cation | 음이온 anion |
| 중성 원자가 하나 이상의 전자를 잃어서 생긴 이온 | 중성 원자가 하나 이상의 전자를 얻어서 생긴 이온 |
이온 결합 화합물 ionic compound: 정전기력에 의해 서로 반대되는 전하를 가진 이온들이 이온 결합을 통해 순차적인 배열로 구성된 화합물을 말하며, 이 화합물은 일정한 비율을 통해 전기적인 중성을 나타낸다.
| 단원자 이온 monatomic ion | 다원자 이온 polyatomic ion |
| 단 하나의 원자만을 포함하는 이온 | 두 개 이상의 원자가 결합하여 알짜 전하를 가진 이온 |
6. 화학식 chemical formula
1) 분자식 molecular formula
: 한 문질의 가장 작은 단위에 있는 각 원소의 원자 개수를 정확히 나타낸다.
※동소체(allotrope): 두 가지 이상의 다른 형태를 가지는 원소(예: 산소 O2와 오존 O3)
| 분자모형 | ||||
| 분자식 molecular formula |
구조식 structural formula |
공-막대모형 | 공간채움 모형 | |
| 물 | H2O | H - O - H |  |
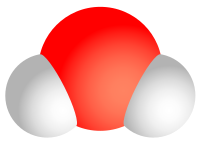 |
2) 실험식 empirical formula
: 존재하는 원소들의 종류와 그 원자들의 가장 간단한 정수비를 나타낸다.
| 분자식 | 화학식 | |
| 하이드라진 Hydrazine | N2H4 | NH2 |
3) 이온 결합 화합물의 화학식
이온 결합 화합물이 전기적으로 중성을 유지하기 위해 각 화학식 단위에 있는 양이온과 음이온의 전하의 합은 0 이어야 한다.
예) 산화 알루미늄은 양이온은 Al3+ 이며, 음이온은 O2-이다. 따라서 산화 알루미늄의 화학식은 Al2O3 이다.
7. 화합물의 명명
| 유기 화합물 organic compound |
무기 화합물 inorganic compound |
|||
| 탄소를 포함하며 주로 수소, 산소, 질소, 황 등의 원소와 결합한다. | 편의상 일산화 탄소(CO), 이산화 탄소(CO2), 이황화 탄소(CS2)와 사이안화기(CN-), 탄산기(CO32-), 중탄산기(HCO3-)를 포함하는 화합물은 무기 화합물로 간주한다. | |||
| 이온 결합 화합물 | 분자 화합물 | 산과 염기 | 수화물 | |
1) 이온 결합 화합물
(1) 이성분 화합물 binary compound, 삼성분 화합물 ternary compound 의 명명법: 한글 표기는 비금속 음이온의 이름을 먼저 쓰곻 금속 양이온의 이름을 나중에 쓴다. 영문 표기는 금속 양이온을 먼저 쓰고 비금속 음이온을 나중에 쓴다. 음이온은 원소 이름의 첫 부분(어간)에 "-화(-ide)"를 붙인다.
| 구분 | 화학식 | 영문 표기 | 한글 표기 |
| 이성분 화합물 | NaCl | sodium chloride | 염화 소듐 |
| KBr | potassium bromide | 브로민화 포타슘 | |
| ZnI2 | zinc iodide | 아이오딘화 아연 | |
| Al2O3 | aluminum oxide | 산화 알루미늄 | |
| 삼성분 화합물 | LiOH | lithium hydroxide | 수산화 리튬 |
| KCN | potassium cyanide | 사이안화 포타슘 |
(2) 전이 금속 transition metal 의 명명법
① 과거 방식: 양전하가 더 적은 양이온에는 "제일", 양전하가 더 많은 양이온에는 "제이"라는 저버두사를 사용한다. 영어명에서는 양전하가 더 적은 양이온에는 "-ous", 양전하가 더 많은 양이온에는 "-ic"라는 접미사를 사용한다.
| 화학식 | 영문 표기 | 한글 표기 |
| FeCl2 | ferrous chloride | 염화 제일철 |
| FeCl3 | ferric chloride | 염화 제이철 |
② 현대 방식: 슈토크 체계 stock system. 로마숫자로 양전하를 나타낸다.
| 화학식 | 영문 표기 | 한글 표기 |
| MnO | manganess(II) oxide | 산화 망가니즈(II) |
| Mn2O3 | manganess(III) oxide | 산화 망가니즈(III) |
| MnO2 | manganess(IV) oxide | 산화 망가니즈(IV) |
'화학' 카테고리의 다른 글
| 화학 공부 이것 저것 (2) | 2022.12.14 |
|---|---|
| 3. 화학 반응에서의 질량 관계 (0) | 2022.08.10 |
| 1. 화학: 변화에 대한 연구 (0) | 2022.06.27 |


